水的电离和溶液的pH教案设计
发布时间:2014-11-05 编辑:教案中心小组 来源:网络&投稿
教学目标
知识目标
了解水的电离和水的离子积;
了解溶液的酸碱性和pH值的关系及有关pH值的简单计算。
能力目标
培养学生的归纳思维能力及知识的综合应用能力。
情感目标
对学生进行对立统一及事物间相互联系与相互制约的辩证唯物主义观点的教育。
教学建议
教材分析
本节内容包括水的电离、水的离子积、水的pH。只有认识水的电离平衡及其移动,才能从本质上认识溶液的酸碱性和pH值。本节的学习也为盐类的水解及电解等知识的教学奠定基础。
教材从实验事实入手,说明水是一种极弱的电解质,存在着电离平衡。由此引出水的电离平衡常数,进而引出水的离子积,并使学生了解水的离子积是个很重要的常数。在25℃时,
,这是本节教学的重点之一。
本节教学的另一个重点是使学生了解在室温时,不仅是纯水,就是在酸性或碱性稀溶液中,其
浓度与
浓度的乘积总是一个常数—
。使学生了解在酸性溶液中,不是没有
,而是其中的
;在碱性溶液中,不是没有
,而是其中的
;在中性溶液中,并不是没有
和
,而是
。使学生了解溶液中
浓度与
浓度的关系,了解溶液酸碱性的本质。工在此基础上,教材介绍了
的含义,将
与
联系起来,并结合图3-7,介绍了有关
的简单计算。图3-8是对本部分内容的小结。
使用
来表示溶液的酸碱性是为了实际使用时更简便,教材的最后提到了溶液的
大于1mol/L时,一般不用
来表示溶液的酸碱性,而是直接用
的浓度来表示,以教育学生应灵活应用所学的知识。
教法建议
从水的电离平衡入手,掌握水的离子积和溶液的pH。
水的离子积的教学是完成本节教学任务的关键,从纯水是弱电解质,只能微弱的电离出发,应用电离理论导出水的离子积常数。推导过程中应着重说明电离前后
几乎不变的原因,并将其看做常数。然后由两个常数的乘积为常数而得出水的离子积常数。启发学生应用平衡移动原理,讨论温度对水的电离平衡的影响,进而得出水的离子积随温度升高而增大这一结论。
关于水溶液的酸碱性的教学是从电离平衡移动入手。
当在纯水中加入强酸时,水的电离平衡向逆方向移动,使氢离子浓度上升,氢氧根离子浓度等倍数下降。如:达到电离平衡时,
增至
,
则会减至
,在溶液中水的离子积仍保持不变。
在水溶液中,
和
是矛盾对立的双方,共处于电解质水溶液的统一体中,它们各以对方的存在为自己存在的条件,相互依存,相互斗争,又相互转化,离子浓度主的一方决定溶液的酸碱性。即:
溶液呈酸性
溶液呈中性
溶液呈碱性
关于溶液pH的教学,指出用
的数值可以表示溶液的酸碱度,但当溶液酸性很弱时,使用
不方便,常采用
的负对数表示溶液的酸碱度,这就是溶液的pH。其数学表达式是:
的负对数叫溶液的pOH,表达式:
在这部分教学中要使学生理解pH的适用范围,理解
与pH间的相互关系。如适用范围是“常温”“水溶液”“稀溶液”,只有在常温下的水溶液,水的离子积Kw才等于
,而当酸、碱溶液的
或
大于1mol/L时,使用负对数表示溶液的酸碱度反而不大方便,此时,可直接用物质的量浓度表示溶液的酸碱度。
导出以下关系:pH + pOH = 14,pH = 14—pOH。利用这一关系可以方便计算出碱溶液的pH。
教学设计示例
课题:水的电离和溶液的pH值
重点:水的离子积,
、
与溶液酸碱性的关系。
难点:水的离子积,有关
的简单计算。
教学过程
引言:
在初中我们学习了溶液的酸、碱度可用pH值表示,这是为什么呢?为什么可以用pH表示溶液的酸性,也可以表示溶液的碱性?唯物辩证法的宇宙观认为:“每一事物的运动都和它周围的其他事物相互联系着和相互影响着。”物质的酸碱性是通过水溶液表现出来的,所以,先研究水的电离。
1.水的电离
[实验演示]用灵敏电流计测定纯水的导电性。
现象:灵敏电流计指针有微弱的偏转。
说明:能导电,但极微弱。
分析原因:纯水中导电的原因是什么?
结论:水是一种极弱电解质,存在有电离平衡:
在25℃时,1L纯水中(即55.56mol/L)测得只有
的
发生电离。
(1)请同学生们分析:该水中
等于多少?
等于多少?
和
有什么关系?
①
②
③
(2)水中
这个乘积叫做水的离子积,用
表示。
(3)请同学从水的电离平衡常数推导水的离子积K。
(4)想一想
①水的电离是吸热?还是放热?
②当温度升高,水的离子积是: (升高,降低或不变)
③当温度降低,水的离子积是: (“增大”,“减小”或“不变”)
[结论]水的电离是个吸热过程,故温度升高,水的
增大。25℃时,
;100℃时,
。
(5)水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱、盐稀溶液。即溶液中
①在酸溶液中,
近似看成是酸电离出来的
浓度,
则来自于水的电离。
且
②在碱溶液中,
近似看成是碱电离出来的
浓度,而
则是来自于水的电离。
[想一想]
为什么酸溶液中还有
?碱溶液中还有
?它们的浓度是如何求出来的?
2.溶液的酸碱性和pH
(1)溶液的酸碱性
常温时,溶液酸碱性与
,
的关系是:
中性溶液:
,
,
越大,酸性越强,
越小,酸性越小。
碱性溶液:
,
,
越大,碱性越强,
越小,碱性越弱。
(2)溶液酸碱性的表示法:
①当
或
大于1mol/L时,可直接用
或
来表示溶液酸碱性。
②若
或
小于1mol/L,如
,或
,这种表示溶液酸碱就很不方便,化学上采用pH来表示溶液酸碱性的强弱。
pH为氢离子物质的量浓度的负常用对数,表示溶液酸碱度强弱。
练习:
1.25℃时,纯水的pH?
解:纯水,25℃时
∴
答:25℃纯水pH为7。
2.物质的量浓度为
盐酸溶液pH?
解:
1 : 1
∴
答:
盐酸pH为2。
3.物质的量浓度为
的
溶液pH?
解:
1 : 1
∴
∴
答:
盐酸pH为12。
③溶液中
,pH与溶液酸碱性关系。
在中性溶液中,
在酸性溶液中,
酸溶液酸性越强,
越大,pH越小。
在碱性溶液中,
碱溶液碱性越强,
越小,pH越大。
重点、难点剖析:
1.影响水电离的因素
(1)温度:电离过程是一个吸热过程,温度越高,水电离程度越大,
也增大。
25℃时,
100℃时,
(2)酸或碱电离出来的
或
都会抑制水的电离,使水电离出来的
与
浓度减小。其对水的电离抑制程度决定于酸碱的
或
,而与酸碱的强弱无关。
(3)溶液的酸碱性越强,水的电离度不一定越小。(具体实例待学习盐水解时介绍)
2.在酸、碱、盐溶液中,水电离出来的
(1)酸溶液中:溶液中
约等于酸电离出来的
,通过求溶液中
;水电离出来的
等于
;
(2)碱溶液中:溶液中
约等于碱电离出来的
,通过求溶液
,此
就是水电离出的
且等于溶液中水电离出来的
。
(3)在水解呈酸性盐溶液中,溶液中
等于水电离出来的
;
在水解呈碱性盐溶液中,溶液中
等于水电离出来的
。
pH计算的基本思路与方法:
一、知识要点
1.
,关键是求溶液的
。
2.强酸溶液中
,直接由电离方程式求算。
3.强碱溶液中
,先根据强碱电离方程式,求出
,再由
4.弱酸溶液
,用近似公式求算:
或
5.弱碱溶液
:先根据近似公式求溶液的
或
二、已知pH的强酸、强碱溶液稀释计算
例1 已知
的盐酸溶液,稀释100倍,求稀释后溶液的pH?
解:∵
∴稀释100倍,则
强酸溶液,当体积扩大100倍,
减少100倍,pH变化2个单位。
即pH由1变为3;溶液
减小,而
浓度增大。pH变大。
例2 已知
的
溶液,稀释100倍,求稀释后溶液pH?
解:∵
∴
稀释100倍:
强碱溶液,当体积扩大100倍,溶液中
减少100倍,pH降低2。
总结、扩展
要 点内 容
水(或溶液)离子积
(25℃)
溶液pH
溶液酸碱性与pH
:
扩展
1.已知强酸、强碱稀溶液的pH,等体积混合后,求混合液pH(近似计算)
适用于选择题型与填空题型的速算规律。
混合前混合后条件
强酸,强碱等体积混合,
2.强酸强碱混合呈中性时二者体积与pH变化规律
(1)若pH酸+pH碱=14,则
;
(2)若pH酸+pH碱>14,则
;
(3)若pH酸+pH碱<14,则
3.强酸(弱碱),弱酸(强碱)加水稀释后的pH变化规律:
(1)强酸,
,加水稀释
倍,则
;
(2)弱酸,
,加水稀释
倍,则
;
(3)强碱,
,加水稀释
倍,则
;
(4)弱碱,
,加水稀释
倍,则
;
(5)酸碱无限稀释,pH只能接近于7,酸不可能大于7,碱不可能小于7。
二个单位,由13变为11。溶液中
减少,
增大,pH变小。
例1 等体积的
和
的两种盐酸溶液,混合后,求混合液pH?(设体积变化忽略不计)。
解:设混合前两种盐酸体积都为
混合前:
,
,溶液中
,
,溶液中
混合后,溶液中氢离子物质的量是原两种溶液中
物质的量总积。
即
∴
答 混合液pH为3.3。
例2 指导学生练习。
和
的两种
溶液等体积混合,求混合液的pH?
板书设计
第二节 水的电离和溶液pH
一、水的电离与离子积
1.水的电离
2.水的离子积
常温下,
(
仅是温度函数)
3.影响水电离的因素
(1)温度:水的电离是吸热过程,升温促使电离,
增大。
(2)溶液中
,
浓度增大,均抑制水的电离,但
不变。
二、溶液的酸碱性与pH值
溶液中
小于1mol/L时,用pH来表示溶液的酸碱性。
关键掌握求不同溶液中的
。
探究习题
pH等于13与pH等于9的两NaOH溶液等体积混合后,所得溶液的pH是多少?
pH等于1与pH等于5的两强酸溶液各10mL,混合后溶液的pH是多少?
并结合以上两题总结出规律。
参考答案:两NaOH溶液等体积混合
分析 先求出两溶液的
,继而求出混合溶液的
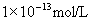
,再据水的离子积求出混合溶液的
,并取
负对数,即可计算出两强碱溶液混合后的pH。
解:pH = 13,
=
,
=
。PH = 9,
。
混合后溶液的
为:
混合后溶液的
为:
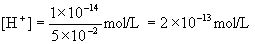
混合后溶液的pH为:
两强酸溶液混合:
分析 pH等于1的强酸溶液
为
,pH值等于5的强酸溶液
为
,混合后溶液的
要用原两强酸所含
的物质的量除以混合后溶液的体积。
解:两强酸溶液混合后的氢离子浓度为:
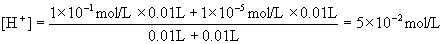
混合溶液的pH为:
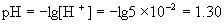
小结:两种强碱溶液等体积混合,所得溶液pH由碱性强的溶液决定,比碱性强的原溶液pH略小,其值为-0.3。两种强酸溶液等体积混合,所得溶液的pH由酸性强的溶液决定,比酸性强的原溶液pH略大,其值为+0.3。
