盐类水解[第一课时]教案
发布时间:2014-11-01 编辑:教案中心小组 来源:网络&投稿
教学目标
知识目标
理解盐类水解的本质。
理解盐类水解对溶液酸、碱性的影响及变化规律。
了解盐类水解的利用。
能力目标
培养学生分析问题的能力。
培养学生运用对比法和依据客观事实解决问题的逻辑思维能力。
培养学生逻辑推理能力。
情感目标
引导学生树立“透过现象,抓住本质”的辩证唯物主义认识观点。
培养学生善于观察、勤于思考的科学态度。
教学建议
教材分析
“盐类的水解”是电解质理论的组成部分,它属于化学基础理论知识。教材把这部分内容安排在强弱电解质和电离平衡之后,目的是使盐类水解过程和规律的探讨能在电离理论和强弱电解质概念的指导下进行, 运用学生已有知识,从中发掘出盐类水解新知识的“生长点”。
本节内容分为三部分:建立盐类水解的概念;探讨盐类水解的规律;运用盐类水解的知识。其中,盐类水解的概念是基础,旨在揭示盐类水解的实质,并为研究盐类水解规律提供依据。盐类水解的规律是核心,它是盐类水解原理的具体化,并使盐类水解一般概念得以直接应用。盐类水解的利用,则是通过具体的情境和应用实例,加深对盐类水解及其规律的理解、巩固。总之,本节教材涉及的知识面较宽,综合性较强,是前面已学过的电解质的电离、水的电离平衡以及平衡移动原理等知识的综合应用。因此,本节教材是本章的重点和难点。
教法建议
本节教师需要为学生提供鲜明的盐类水解的实验事实,启发学生思考,引导学生探究,深入探讨实验的微观本质,并利用多媒体教学手段,帮助学生实现从感性认识到理性认识的飞跃,以形成盐类水解的概念;对于盐的水解规律,要突出个别与一般的辩证关系,要依据教材的典型实例,运用归纳法揭示两类盐(强酸弱碱盐、强碱弱酸盐)水解的规律;对于盐类水解的离子方程式和化学方程式的书写,在教学中要强调书写的规范要求和注意事项,并加强训练。最后,运用演绎法,讨论盐类水解知识在实际中的运用,加深对盐类水解本质及其规律的认识。具体建议如下:
1.知识准备(布置预习作业):中和反应可表示为“酸+碱==盐+水”,因此可把盐理解为是由相应的酸和碱反应完成的,又因为酸有强酸、弱酸,碱有强碱、弱碱,所以生成的盐就有四种,即强酸弱碱盐、弱酸弱碱盐、弱酸强碱盐、强酸强碱盐。要求上述四种类型的盐各举出2—3例(写化学式)
2.采用实验探究方法引入新课。 建议将教材中的[实验3-1]改为学生实验,并增加一个演示实验,即“向盛有固体Na2CO3和NH4Cl两支试管分别注入3--4ml蒸馏水,振荡使之溶解,再分别滴加2-3滴酚酞试液和紫色石蕊试液,观察溶液颜色变化”,这样使学生通过实验现象,“发现”盐溶液不都呈中性,引出课题。
3.对于“盐类水解的本质”, 建议通过分析CH3COONa、AlCl3的水解,引导学生总结出盐类水解的本质。
4.对于“强酸强碱盐不水解”这部分内容的教学也不容忽视,学生只有理解了强酸强碱盐不水解才能更好地理解盐类水解的本质和条件;而对于“弱酸弱碱盐的水解”只要求学生会判断该类盐能水解就可以了,不要扩展。
5.在讲解如何书写盐类水解的离子方程式和化学方程式时,要强调说明以下问题:
①盐类水解反应一般是可逆反应,反应方程式中要写“ ”号。
②一般盐类水解的程度很小,水解产物的量也很少,通常不生成沉淀或气体,也不发生分解,在书写方程式时,一般不标“↑”或“↓”,也不把生成物写成其分解产物的形式。(如H2CO3,NH3.H2O等)
③多元弱酸的盐的水解反应分步写方程式,但以第一步为主(如H2CO3);多元弱碱盐水解不分步写(如AlCl3)。
④盐类水解反应可视作中和反应的逆反应。
6.“影响盐类水解的外界因素”的教学,对于重点中学,可启发学生运用实验手段自主探究;对于普通中学,可采取教师演示实验。同时使学生认识到盐本身的性质才是主要因素,渗透内、外因的辩证关系。
7.对于“盐类水解的利用”,除了教材中提到的溶液的配制、除杂外,在多举一些应用实例,如化肥混施、明矾净水,以丰富学生的视野。
8.本节内容结束前,总结归纳盐类水解知识的应用,以便将知识系统化,规律化,便于学生掌握,同时也教会学生学习。
教学设计方案一
重点:理解盐类水解的本质
难点:盐类水解方程式的书写和分析
第一课时
(一)知识准备
酸+碱=盐+水(中和反应,可以理解盐可以由相应的酸和碱反应生成)

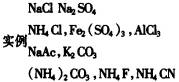
【实验】在教师的指导下由学生完成下面的实验,激发学生学习兴趣。
(1)向盛有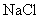 ,
, 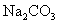 ,
, 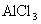 的试管中分别加入3~4ml蒸馏水,振荡,使之溶解。
的试管中分别加入3~4ml蒸馏水,振荡,使之溶解。
(2)用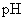 试纸测定三种盐溶液的
试纸测定三种盐溶液的 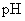 ,
,
并记录:
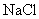
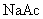
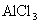
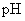 :
:
【设疑】
(1)为什么三种盐的水溶液有的呈中性?有的呈碱性?有的呈酸性呢?
(2)同呈中性的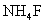 和
和 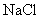 其实质是否相同呢?
其实质是否相同呢?
【讲解】这是由于盐类水解的原因,下面我们就来学习盐类的水解及其实质。
【设疑】同样是盐溶液为什么有的显碱性,有的显酸性?
【讲解】
①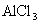 溶液(弱碱强酸盐,水溶液
溶液(弱碱强酸盐,水溶液 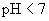 ,呈酸性)
,呈酸性)
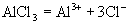 (盐电离强电解质电离是完全的)
(盐电离强电解质电离是完全的)
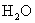

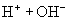 (水电离,弱电解电离是部分的,可逆的)
(水电离,弱电解电离是部分的,可逆的)
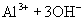

 由于生成难电离的弱电解质
由于生成难电离的弱电解质  促使水的电离,使溶液中
促使水的电离,使溶液中 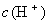 增大,从而使溶液呈酸性。
增大,从而使溶液呈酸性。
水解方程式: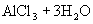

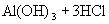
水解离子方程式: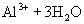

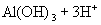
②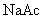 溶液(强碱弱酸盐,水溶液
溶液(强碱弱酸盐,水溶液 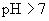 ,呈碱性)
,呈碱性)
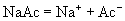 (盐,弱电解质,完全电离)
(盐,弱电解质,完全电离)
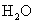

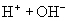 (水,弱电解质,存在电离平衡)
(水,弱电解质,存在电离平衡)
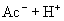

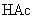 由于生成难电离的弱电解质
由于生成难电离的弱电解质 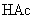 分子,使溶液中
分子,使溶液中 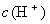 减少,促使
减少,促使 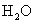 的电离,从而使溶液中
的电离,从而使溶液中 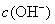 增大,溶液呈现碱性。
增大,溶液呈现碱性。
【设疑】盐溶液是碱性,溶液中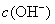 增大?为什么会增大呢?
增大?为什么会增大呢? 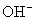 是从哪来的呢?
是从哪来的呢?
盐溶液呈酸性,溶液中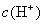 增大?为什么会增大呢?
增大?为什么会增大呢? 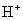 是从哪来的呢?
是从哪来的呢?
【讲解】
①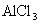 溶液(弱碱强酸盐,水溶液
溶液(弱碱强酸盐,水溶液 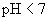 ,呈酸性)
,呈酸性)
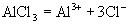 (盐电离强电解质电离是完全的)
(盐电离强电解质电离是完全的)
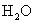

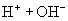 (水电离,弱电解电离是部分的,可逆的)
(水电离,弱电解电离是部分的,可逆的)
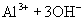

 由于生成难电离的弱电解质
由于生成难电离的弱电解质  促使水的电离,使溶液中
促使水的电离,使溶液中 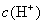 增大,从而使溶液呈酸性。
增大,从而使溶液呈酸性。
水解方程式: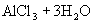

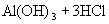
水解离子方程式: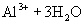

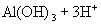
②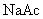 溶液(强碱弱酸盐,水溶液
溶液(强碱弱酸盐,水溶液 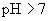 ,呈碱性)
,呈碱性)
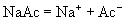 (盐,弱电解质,完全电离)
(盐,弱电解质,完全电离)
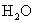

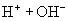 (水,弱电解质,存在电离平衡)
(水,弱电解质,存在电离平衡)
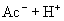

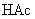 由于生成难电离的弱电解质
由于生成难电离的弱电解质 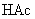 分子,使溶液中
分子,使溶液中 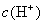 减少,促使
减少,促使 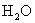 的电离,从而使溶液中
的电离,从而使溶液中 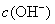 增大,溶液呈现碱性。
增大,溶液呈现碱性。
③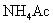 溶液
溶液
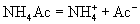 (盐,强电解质,完全电离)
(盐,强电解质,完全电离)
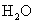

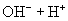
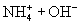

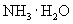
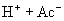

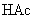 由于
由于 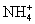 结合
结合 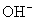 的能力与
的能力与 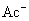 的能力相当,使溶液中
的能力相当,使溶液中 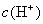 与
与 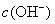 仍相等,所以溶液呈中性。
仍相等,所以溶液呈中性。
(三)随堂练习
1.在水中加入下列物质,可使水的电离平衡向电离方向移动的是( )
A.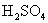 B.
B. 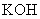 C.
C. 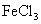 D.
D. 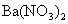
2.判断下列盐类水解的叙述中正确的是( )
A.溶液呈中性的盐一定是强酸、强碱生成的盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸脓性主要决定于形成盐的酸和碱的相对强弱
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的两倍
3.物质的量浓度相同的下列溶液中,含微粒种类最多的是( )
A.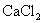 B.
B. 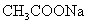 C.
C. 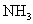 D.
D. 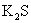
4.下列各组离子,在强碱性溶液中可以大量共存的是( )
A. B.
B. 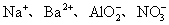
C.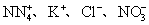 D.
D. 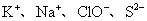
5.为了使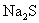 溶液中
溶液中 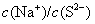 的比值变小,可加入的物质是( )
的比值变小,可加入的物质是( )
A.适量盐酸 B.适量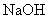 溶液
溶液
C.适量KOH溶液 D.适量KHS溶液
(四)总结、扩展
1.盐类水解的实质
在溶液中,由于盐的离子与水电离出来的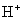 和
和 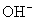 生成弱电解质,从而破坏水的电离平衡,使溶液显示出不同程度的酸性、碱性或中性。
生成弱电解质,从而破坏水的电离平衡,使溶液显示出不同程度的酸性、碱性或中性。
2.盐类水解的类型和规律
(1)通常盐类水解程度是很小的,而且是可逆的。
(2)水解规律:
有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。
①强酸弱碱生成的盐水解:溶液呈酸性,是弱碱的阳离子水解生成对应的弱碱,使溶液显酸性。如: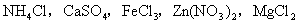 等。
等。
②强碱弱酸生成的盐水解,溶液呈碱性,原因是弱酸根发生水解,生成对应弱酸,使溶液显碱性,如: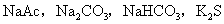 等。
等。
③强酸强碱盐不水解,溶液呈中性,如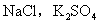 等。
等。
④弱酸弱碱盐强烈水解。(此内容大纲不作要求,不宜向学生补充)
a.酸强于碱,显酸性,如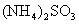 ;
;
b.碱强于酸,显碱性,如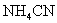
c.酸碱相当,显中性,如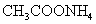
⑤弱酸酸式盐水解:取决于酸式酸根的电离程度和水解程度相对大小。
a.若电离程度大于水解程度,溶液呈酸性,如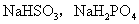 等。
等。
b.若电离程度小于水解程度,溶液呈碱性,如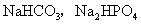 等。
等。
3.扩展
氮、磷、钾是植物生长的重要营养元素,洗衣粉中加入由磷酸脱水制得的多磷酸的钠盐作配料,能起到软化水的作用,但使用此类洗衣粉会造成水质污染。
(1)试简述污染水质的原因。
(2)某种无磷洗衣粉中加入了硅酸钠作配料,试说明这种配料的有关性质和作用。
板书设计
一、盐的组成类别
1.强酸强碱盐:如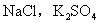 等;
等;
2.强酸弱碱盐:如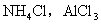 等;
等;
3.弱酸弱碱盐:如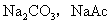 等;
等;
4.弱酸弱碱盐:如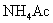 等;
等;
二、实验测定盐溶液的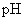 是不是都等于7
是不是都等于7
1.测蒸馏水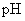 ;
;
2.测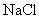 溶液
溶液 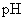 ;
;
3.测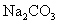 溶液
溶液 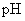 ;
;
4.测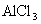 溶液
溶液 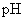 值。
值。
列表比较:
提出问题:为什么都是盐溶液的(2)(3)(4)三种溶液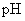 会有显著差异呢?
会有显著差异呢?
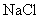 :强酸强碱盐
:强酸强碱盐 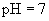 ;
;
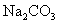 :强碱弱酸盐
:强碱弱酸盐 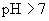 ;
;
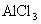 :强碱强酸盐
:强碱强酸盐 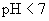 ;
;
剖析原因:写出离子方程式及化学方程式。
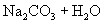

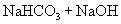
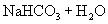

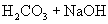
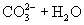

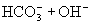
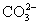 与
与 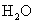 电离出来
电离出来 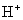 结合成弱电解质
结合成弱电解质 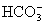
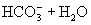

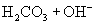 破坏了水电离平衡,减少水电离,使溶液中
破坏了水电离平衡,减少水电离,使溶液中 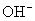 浓度增大,碱性增强。
浓度增大,碱性增强。
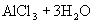

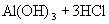
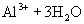

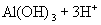
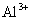 与
与 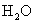 电离出来的
电离出来的 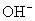 结合生成弱碱
结合生成弱碱  ,破坏了水电离平衡,促使水电离,使溶液中
,破坏了水电离平衡,促使水电离,使溶液中 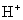 浓度增大,酸性增强。
浓度增大,酸性增强。
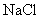 强酸、强碱盐,不水解只电离。溶液显中性。
强酸、强碱盐,不水解只电离。溶液显中性。
三、引出水解定义,归纳水解一般规律
1.定义:在溶液中盐电离出来的离子跟水电离出来的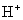 或
或 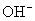 结合生成弱电解质的反应叫做盐类水解。
结合生成弱电解质的反应叫做盐类水解。
2.水解一般规律:
谁弱谁水解:水解离子一定是盐电离出来的弱离子(弱酸阴离子,或弱碱阳离子)。
谁强显谁性:碱强显碱性,酸强显酸性。
都强不水解。
都弱都水解(了解就可)
知识目标
理解盐类水解的本质。
理解盐类水解对溶液酸、碱性的影响及变化规律。
了解盐类水解的利用。
能力目标
培养学生分析问题的能力。
培养学生运用对比法和依据客观事实解决问题的逻辑思维能力。
培养学生逻辑推理能力。
情感目标
引导学生树立“透过现象,抓住本质”的辩证唯物主义认识观点。
培养学生善于观察、勤于思考的科学态度。
教学建议
教材分析
“盐类的水解”是电解质理论的组成部分,它属于化学基础理论知识。教材把这部分内容安排在强弱电解质和电离平衡之后,目的是使盐类水解过程和规律的探讨能在电离理论和强弱电解质概念的指导下进行, 运用学生已有知识,从中发掘出盐类水解新知识的“生长点”。
本节内容分为三部分:建立盐类水解的概念;探讨盐类水解的规律;运用盐类水解的知识。其中,盐类水解的概念是基础,旨在揭示盐类水解的实质,并为研究盐类水解规律提供依据。盐类水解的规律是核心,它是盐类水解原理的具体化,并使盐类水解一般概念得以直接应用。盐类水解的利用,则是通过具体的情境和应用实例,加深对盐类水解及其规律的理解、巩固。总之,本节教材涉及的知识面较宽,综合性较强,是前面已学过的电解质的电离、水的电离平衡以及平衡移动原理等知识的综合应用。因此,本节教材是本章的重点和难点。
教法建议
本节教师需要为学生提供鲜明的盐类水解的实验事实,启发学生思考,引导学生探究,深入探讨实验的微观本质,并利用多媒体教学手段,帮助学生实现从感性认识到理性认识的飞跃,以形成盐类水解的概念;对于盐的水解规律,要突出个别与一般的辩证关系,要依据教材的典型实例,运用归纳法揭示两类盐(强酸弱碱盐、强碱弱酸盐)水解的规律;对于盐类水解的离子方程式和化学方程式的书写,在教学中要强调书写的规范要求和注意事项,并加强训练。最后,运用演绎法,讨论盐类水解知识在实际中的运用,加深对盐类水解本质及其规律的认识。具体建议如下:
1.知识准备(布置预习作业):中和反应可表示为“酸+碱==盐+水”,因此可把盐理解为是由相应的酸和碱反应完成的,又因为酸有强酸、弱酸,碱有强碱、弱碱,所以生成的盐就有四种,即强酸弱碱盐、弱酸弱碱盐、弱酸强碱盐、强酸强碱盐。要求上述四种类型的盐各举出2—3例(写化学式)
2.采用实验探究方法引入新课。 建议将教材中的[实验3-1]改为学生实验,并增加一个演示实验,即“向盛有固体Na2CO3和NH4Cl两支试管分别注入3--4ml蒸馏水,振荡使之溶解,再分别滴加2-3滴酚酞试液和紫色石蕊试液,观察溶液颜色变化”,这样使学生通过实验现象,“发现”盐溶液不都呈中性,引出课题。
3.对于“盐类水解的本质”, 建议通过分析CH3COONa、AlCl3的水解,引导学生总结出盐类水解的本质。
4.对于“强酸强碱盐不水解”这部分内容的教学也不容忽视,学生只有理解了强酸强碱盐不水解才能更好地理解盐类水解的本质和条件;而对于“弱酸弱碱盐的水解”只要求学生会判断该类盐能水解就可以了,不要扩展。
5.在讲解如何书写盐类水解的离子方程式和化学方程式时,要强调说明以下问题:
①盐类水解反应一般是可逆反应,反应方程式中要写“ ”号。
②一般盐类水解的程度很小,水解产物的量也很少,通常不生成沉淀或气体,也不发生分解,在书写方程式时,一般不标“↑”或“↓”,也不把生成物写成其分解产物的形式。(如H2CO3,NH3.H2O等)
③多元弱酸的盐的水解反应分步写方程式,但以第一步为主(如H2CO3);多元弱碱盐水解不分步写(如AlCl3)。
④盐类水解反应可视作中和反应的逆反应。
6.“影响盐类水解的外界因素”的教学,对于重点中学,可启发学生运用实验手段自主探究;对于普通中学,可采取教师演示实验。同时使学生认识到盐本身的性质才是主要因素,渗透内、外因的辩证关系。
7.对于“盐类水解的利用”,除了教材中提到的溶液的配制、除杂外,在多举一些应用实例,如化肥混施、明矾净水,以丰富学生的视野。
8.本节内容结束前,总结归纳盐类水解知识的应用,以便将知识系统化,规律化,便于学生掌握,同时也教会学生学习。
教学设计方案一
重点:理解盐类水解的本质
难点:盐类水解方程式的书写和分析
第一课时
(一)知识准备
酸+碱=盐+水(中和反应,可以理解盐可以由相应的酸和碱反应生成)

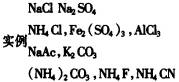
【实验】在教师的指导下由学生完成下面的实验,激发学生学习兴趣。
(1)向盛有
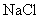 ,
, 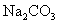 ,
, 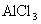 的试管中分别加入3~4ml蒸馏水,振荡,使之溶解。
的试管中分别加入3~4ml蒸馏水,振荡,使之溶解。(2)用
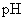 试纸测定三种盐溶液的
试纸测定三种盐溶液的 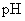 ,
,并记录:
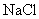
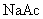
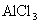
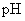 :
:【设疑】
(1)为什么三种盐的水溶液有的呈中性?有的呈碱性?有的呈酸性呢?
(2)同呈中性的
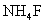 和
和 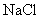 其实质是否相同呢?
其实质是否相同呢?【讲解】这是由于盐类水解的原因,下面我们就来学习盐类的水解及其实质。
【设疑】同样是盐溶液为什么有的显碱性,有的显酸性?
【讲解】
①
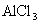 溶液(弱碱强酸盐,水溶液
溶液(弱碱强酸盐,水溶液 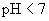 ,呈酸性)
,呈酸性)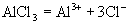 (盐电离强电解质电离是完全的)
(盐电离强电解质电离是完全的)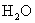

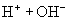 (水电离,弱电解电离是部分的,可逆的)
(水电离,弱电解电离是部分的,可逆的)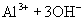

 由于生成难电离的弱电解质
由于生成难电离的弱电解质  促使水的电离,使溶液中
促使水的电离,使溶液中 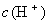 增大,从而使溶液呈酸性。
增大,从而使溶液呈酸性。水解方程式:
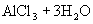

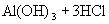
水解离子方程式:
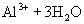

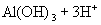
②
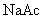 溶液(强碱弱酸盐,水溶液
溶液(强碱弱酸盐,水溶液 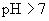 ,呈碱性)
,呈碱性)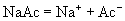 (盐,弱电解质,完全电离)
(盐,弱电解质,完全电离)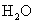

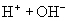 (水,弱电解质,存在电离平衡)
(水,弱电解质,存在电离平衡)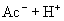

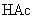 由于生成难电离的弱电解质
由于生成难电离的弱电解质 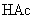 分子,使溶液中
分子,使溶液中 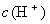 减少,促使
减少,促使 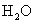 的电离,从而使溶液中
的电离,从而使溶液中 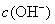 增大,溶液呈现碱性。
增大,溶液呈现碱性。【设疑】盐溶液是碱性,溶液中
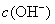 增大?为什么会增大呢?
增大?为什么会增大呢? 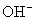 是从哪来的呢?
是从哪来的呢?盐溶液呈酸性,溶液中
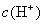 增大?为什么会增大呢?
增大?为什么会增大呢? 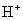 是从哪来的呢?
是从哪来的呢?【讲解】
①
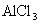 溶液(弱碱强酸盐,水溶液
溶液(弱碱强酸盐,水溶液 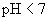 ,呈酸性)
,呈酸性)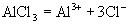 (盐电离强电解质电离是完全的)
(盐电离强电解质电离是完全的)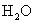

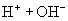 (水电离,弱电解电离是部分的,可逆的)
(水电离,弱电解电离是部分的,可逆的)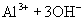

 由于生成难电离的弱电解质
由于生成难电离的弱电解质  促使水的电离,使溶液中
促使水的电离,使溶液中 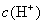 增大,从而使溶液呈酸性。
增大,从而使溶液呈酸性。水解方程式:
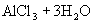

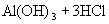
水解离子方程式:
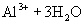

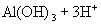
②
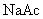 溶液(强碱弱酸盐,水溶液
溶液(强碱弱酸盐,水溶液 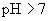 ,呈碱性)
,呈碱性)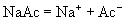 (盐,弱电解质,完全电离)
(盐,弱电解质,完全电离)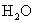

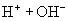 (水,弱电解质,存在电离平衡)
(水,弱电解质,存在电离平衡)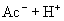

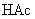 由于生成难电离的弱电解质
由于生成难电离的弱电解质 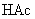 分子,使溶液中
分子,使溶液中 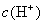 减少,促使
减少,促使 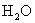 的电离,从而使溶液中
的电离,从而使溶液中 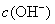 增大,溶液呈现碱性。
增大,溶液呈现碱性。③
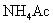 溶液
溶液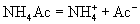 (盐,强电解质,完全电离)
(盐,强电解质,完全电离)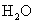

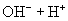
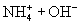

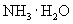
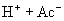

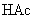 由于
由于 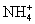 结合
结合 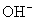 的能力与
的能力与 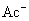 的能力相当,使溶液中
的能力相当,使溶液中 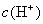 与
与 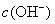 仍相等,所以溶液呈中性。
仍相等,所以溶液呈中性。(三)随堂练习
1.在水中加入下列物质,可使水的电离平衡向电离方向移动的是( )
A.
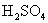 B.
B. 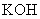 C.
C. 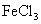 D.
D. 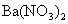
2.判断下列盐类水解的叙述中正确的是( )
A.溶液呈中性的盐一定是强酸、强碱生成的盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸脓性主要决定于形成盐的酸和碱的相对强弱
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的两倍
3.物质的量浓度相同的下列溶液中,含微粒种类最多的是( )
A.
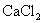 B.
B. 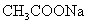 C.
C. 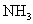 D.
D. 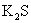
4.下列各组离子,在强碱性溶液中可以大量共存的是( )
A.
 B.
B. 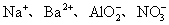
C.
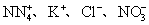 D.
D. 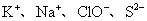
5.为了使
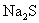 溶液中
溶液中 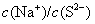 的比值变小,可加入的物质是( )
的比值变小,可加入的物质是( )A.适量盐酸 B.适量
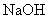 溶液
溶液C.适量KOH溶液 D.适量KHS溶液
(四)总结、扩展
1.盐类水解的实质
在溶液中,由于盐的离子与水电离出来的
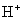 和
和 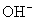 生成弱电解质,从而破坏水的电离平衡,使溶液显示出不同程度的酸性、碱性或中性。
生成弱电解质,从而破坏水的电离平衡,使溶液显示出不同程度的酸性、碱性或中性。2.盐类水解的类型和规律
(1)通常盐类水解程度是很小的,而且是可逆的。
(2)水解规律:
有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。
①强酸弱碱生成的盐水解:溶液呈酸性,是弱碱的阳离子水解生成对应的弱碱,使溶液显酸性。如:
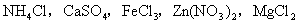 等。
等。②强碱弱酸生成的盐水解,溶液呈碱性,原因是弱酸根发生水解,生成对应弱酸,使溶液显碱性,如:
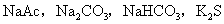 等。
等。③强酸强碱盐不水解,溶液呈中性,如
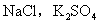 等。
等。④弱酸弱碱盐强烈水解。(此内容大纲不作要求,不宜向学生补充)
a.酸强于碱,显酸性,如
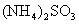 ;
;b.碱强于酸,显碱性,如
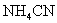
c.酸碱相当,显中性,如
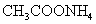
⑤弱酸酸式盐水解:取决于酸式酸根的电离程度和水解程度相对大小。
a.若电离程度大于水解程度,溶液呈酸性,如
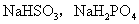 等。
等。b.若电离程度小于水解程度,溶液呈碱性,如
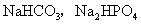 等。
等。3.扩展
氮、磷、钾是植物生长的重要营养元素,洗衣粉中加入由磷酸脱水制得的多磷酸的钠盐作配料,能起到软化水的作用,但使用此类洗衣粉会造成水质污染。
(1)试简述污染水质的原因。
(2)某种无磷洗衣粉中加入了硅酸钠作配料,试说明这种配料的有关性质和作用。
板书设计
一、盐的组成类别
1.强酸强碱盐:如
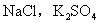 等;
等;2.强酸弱碱盐:如
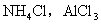 等;
等;3.弱酸弱碱盐:如
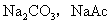 等;
等;4.弱酸弱碱盐:如
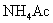 等;
等;二、实验测定盐溶液的
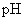 是不是都等于7
是不是都等于71.测蒸馏水
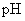 ;
;2.测
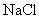 溶液
溶液 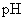 ;
;3.测
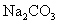 溶液
溶液 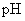 ;
;4.测
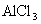 溶液
溶液 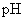 值。
值。列表比较:
提出问题:为什么都是盐溶液的(2)(3)(4)三种溶液
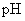 会有显著差异呢?
会有显著差异呢?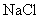 :强酸强碱盐
:强酸强碱盐 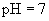 ;
;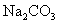 :强碱弱酸盐
:强碱弱酸盐 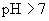 ;
;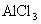 :强碱强酸盐
:强碱强酸盐 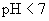 ;
;剖析原因:写出离子方程式及化学方程式。
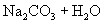

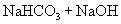
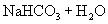

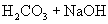
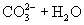

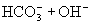
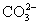 与
与 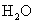 电离出来
电离出来 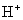 结合成弱电解质
结合成弱电解质 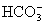
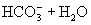

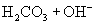 破坏了水电离平衡,减少水电离,使溶液中
破坏了水电离平衡,减少水电离,使溶液中 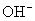 浓度增大,碱性增强。
浓度增大,碱性增强。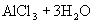

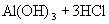
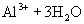

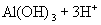
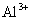 与
与 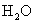 电离出来的
电离出来的 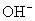 结合生成弱碱
结合生成弱碱  ,破坏了水电离平衡,促使水电离,使溶液中
,破坏了水电离平衡,促使水电离,使溶液中 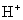 浓度增大,酸性增强。
浓度增大,酸性增强。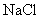 强酸、强碱盐,不水解只电离。溶液显中性。
强酸、强碱盐,不水解只电离。溶液显中性。三、引出水解定义,归纳水解一般规律
1.定义:在溶液中盐电离出来的离子跟水电离出来的
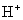 或
或 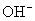 结合生成弱电解质的反应叫做盐类水解。
结合生成弱电解质的反应叫做盐类水解。2.水解一般规律:
谁弱谁水解:水解离子一定是盐电离出来的弱离子(弱酸阴离子,或弱碱阳离子)。
谁强显谁性:碱强显碱性,酸强显酸性。
都强不水解。
都弱都水解(了解就可)
