物质的量[第二课时]教案
发布时间:2014-11-01 编辑:教案中心小组 来源:网络&投稿
教学设计方案二
课题 第一节 物质的量
第二课时
知识目标:
1.使学生了解摩尔质量的概念。了解摩尔质量与相对原子质量、相对分子质量之间的关系。
2.使学生了解物质的量、摩尔质量、物质的质量之间的关系。掌握有关概念的计算。
3. 进一步加深理解巩固物质的量和摩尔的概念。
能力目标:
培养学生的逻辑推理、抽象概括的能力。
培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
情感目标:
使学生认识到微观和宏观的相互转化是研究化学的科学方法之一。培养学生尊重科学的思想。
强调解题规范化,单位使用准确,养成良好的学习习惯。
教学重点:摩尔质量的概念和相关计算
教学难点:摩尔质量与相对原子质量、相对分子质量之间的关系
教学方法:探究式
教学过程
[复习提问]什么是物质的量?什么是摩尔?它们的使用范围是什么?
[回答]物质的量是表示物质所含粒子多少的物理量,摩尔是物质的量的单位。每摩尔物质都含有阿伏加德罗常数个粒子,阿伏加德罗常数的近似值为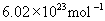 。物质的量和摩尔都只适用于微观粒子,不能用于宏观物体。在使用物质的量时应该用化学式指明粒子的种类。
。物质的量和摩尔都只适用于微观粒子,不能用于宏观物体。在使用物质的量时应该用化学式指明粒子的种类。
[引言]既然物质的量是联系微观粒子和宏观物质的桥梁,那么如何通过物质的量求出物质的质量呢?也就是说1mol物质的质量到底有多大呢?我们先填写下面的表格,看是否可以从这些数据中得出有用的结论。
粒子符号物质的
式量每个粒子的质量
(g/个)1摩尔物质含有的
粒子数(个)1摩尔物质质量
(g)
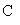
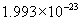
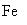
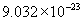
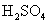
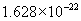
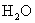
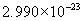
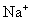
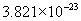
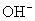
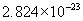
[答案]C的相对原子质量为12,1mol碳原子含有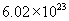 个碳原子,1mol碳原子的质量为
个碳原子,1mol碳原子的质量为 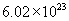 个
个 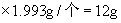 。同理Fe的相对原子质量是56,1mol铁原子含
。同理Fe的相对原子质量是56,1mol铁原子含 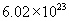 个铁原子,是56g。
个铁原子,是56g。 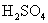 的相对分子质量是98,1mol硫酸含
的相对分子质量是98,1mol硫酸含 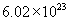 个硫酸分子,是98g。
个硫酸分子,是98g。 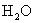 的相对分子质量是18,1mol水含
的相对分子质量是18,1mol水含 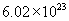 个水分子,质量是18g。电子质量过于微小,因此失去或得到电子的质量可忽略不计,所以
个水分子,质量是18g。电子质量过于微小,因此失去或得到电子的质量可忽略不计,所以 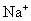 的式量是23。1mol钠离子含有
的式量是23。1mol钠离子含有 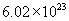 个钠离子,是23g。
个钠离子,是23g。 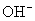 的式量为17。1mol氢氧根离子含
的式量为17。1mol氢氧根离子含 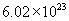 个氢氧根离子,是17g。
个氢氧根离子,是17g。
[学生思考]由以上计算结果可得出什么规律?
[结论]①1mol任何原子的质量在数值上等于这种原子的相对原子质量。
②1mol任何分子的质量在数值上等于这种分子的相对分子质量。
③1mol任何离子的质量在数值上等于这种离子的式量。
(此处还可以用其他方法引入得出结论。例如:通过推导得出
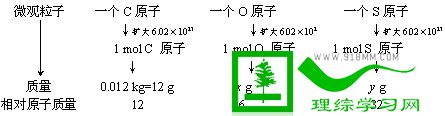
[讲解]因为任何一种原子的相对原子质量,是以12C的1/12为标准所得的比值。所以,1 mol任何原子的质量比,就等于它们的相对原子质量比。由此我们可求出x值和y值。
计算得出x=16g y=32g
[得出结论]1 mol任何原子的质量,若以克为单位,在数值上等于其相对原子质量。那么由原子构成的分子,1mol分子的质量应该在数值上等于其相对分子质量。而对于离子,由于电子的质量很小,可以忽略不计。因此1mol任何离子的质量在数值上等于这种离子的式量。)
[板书]二、摩尔质量
1.1mol物质质量
1mol任何粒子或物质的质量是以克为单位,在数值上都与该粒子相对原子质量或相对分子质量相等。
[讨论]为什么1mol任何物质质量在数值上等于该物质的式量?
[分析]相对原子质量是以
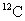 质量的1/12为标准,其他原子的质量跟它相比较所得的比值。如氧的相对原子质量是16。一个碳原子的质量跟一个氧原子的质量之比是12:16,因1mol碳原子与1mol氧原子含有的原子数相等,都约为
质量的1/12为标准,其他原子的质量跟它相比较所得的比值。如氧的相对原子质量是16。一个碳原子的质量跟一个氧原子的质量之比是12:16,因1mol碳原子与1mol氧原子含有的原子数相等,都约为 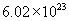 ,所以1摩尔碳原子质量跟1摩尔氧原子质量之比也应该是12:16。1mol碳原子质量是12g,那么1mol氧原子质量就是16g,同理1mol任何原子的质量就是以克为单位,数值上等于该种原子的相对原子质量。对于由分子构成的物质,由于分子是由原子构成的,相对分子质量是各种元素的相对原子质量之和,因此1mol任何分子的质量就是以克为单位,数值上等于该分子的相对分子质量。离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计,所以1mol任何离子的质量在数值上等于该离子的式量。根据以上分析得出1mol任何物质的质量,以克为单位,数值上等于该物质的式量。
,所以1摩尔碳原子质量跟1摩尔氧原子质量之比也应该是12:16。1mol碳原子质量是12g,那么1mol氧原子质量就是16g,同理1mol任何原子的质量就是以克为单位,数值上等于该种原子的相对原子质量。对于由分子构成的物质,由于分子是由原子构成的,相对分子质量是各种元素的相对原子质量之和,因此1mol任何分子的质量就是以克为单位,数值上等于该分子的相对分子质量。离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计,所以1mol任何离子的质量在数值上等于该离子的式量。根据以上分析得出1mol任何物质的质量,以克为单位,数值上等于该物质的式量。
[投影]课堂练习
1.填写下列空白
(1)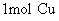 原子质量是 克
原子质量是 克
(2)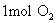 分子质量是 克
分子质量是 克
(3)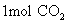 分子质量是 克
分子质量是 克
(4)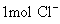 离子质量是 克
离子质量是 克
(5)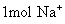 离子质量是 克
离子质量是 克
(6)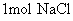 质量是 克
质量是 克
[回答]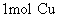 原子是64g;
原子是64g; 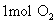 分子是32g;
分子是32g; 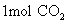 分子是44g;
分子是44g; 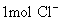 离子为35.5g;
离子为35.5g; 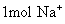 离子是23g;
离子是23g; 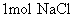 质量为58.5g。
质量为58.5g。
[设问]能否说一说什么是摩尔质量?它的单位是什么?数值怎样确定?
[讲述]我们将单位物质的量的物质所具有的质量叫做摩尔质量。也就是说物质的摩尔质量是该物质的质量与该物质的量之比。摩尔质量的符号是M,常用的单位为g/mol或kg/mol。
[板书]2.摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。符号M。
(2)单位:g/mol或kg/mol。
(3)数值:等于物质或粒子的式量。
[投影]课堂练习
2.回答下列问题
(1)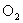 的摩尔质量是多少?
的摩尔质量是多少?
(2)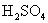 的摩尔质量是多少?
的摩尔质量是多少?
回答:(1)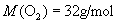 ;
;
(2)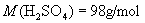
[投影]课堂练习
3.下列物质各多少克?含粒子数多少个?
(1)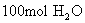 (2)
(2) 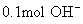
回答:(1)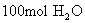 质量是1800g,含有
质量是1800g,含有 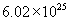 个
个 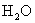 分子。
分子。
(2)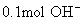 质量是1.7g,含
质量是1.7g,含 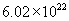 个
个 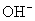
4.下列物质的物质的量是多少?含有多少个粒子?
(1)90g水 (2)56g氮气
[回答](1)90g水物质的量为5mol,含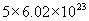 个
个 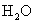 分子
分子
(2)56g氮气物质的量为2mol,含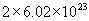 个
个 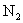 分子
分子
[设问]通过以上练习,能不能总结出物质的质量、物质的量、摩尔质量三者间的关系?
[回答]物质的摩尔质量是该物质的质量与该物质的量之比。
[讲述]根据物质的质量和摩尔质量可求出物质的量,反之根据物质的量和摩尔质量也可求出物质的质量。
[板书]三、关于物质的量的计算
(-)依据
[板书]1.准确掌握物质的量、摩尔、摩尔质量等概念。
2.掌握好有关物质的质量(m)、物质的量(n)和粒子数(N)之间的关系。
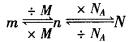
(二)类型
1.物质的质量、物质的量和粒子数之间的相互换算。
[投影]例1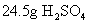 的物质的量是多少?
的物质的量是多少?
[分析]我们可以通过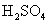 的相对分子质量,得知
的相对分子质量,得知 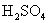 的摩尔质量。然后利用关系式
的摩尔质量。然后利用关系式 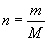 计算出
计算出 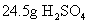 的物质的量。
的物质的量。
解: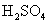 的相对分子质量为98,摩尔质量为
的相对分子质量为98,摩尔质量为 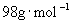 。
。
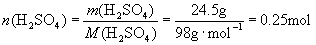
答: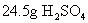 的物质的量为0.25mol
的物质的量为0.25mol
[投影]例2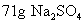 中含有
中含有 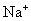 和
和 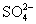 的物质的量各是多少?
的物质的量各是多少?
[分析]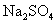 的电离方程式为:
的电离方程式为:
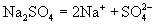
从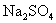 的电离方程式中我们可以看出,
的电离方程式中我们可以看出, 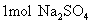 可以电离出
可以电离出 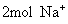 和
和 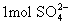 。
。
我们可以利用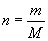 的关系,首先计算出
的关系,首先计算出 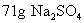 的物质的量,然后再计算出
的物质的量,然后再计算出 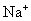 和
和 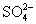 的物质的量。
的物质的量。
解: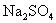 的相对分子质量为142,摩尔质量为
的相对分子质量为142,摩尔质量为 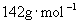 。
。
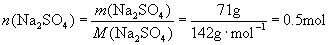
则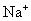 的物质的量为1mol,
的物质的量为1mol, 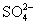 的物质的量为0.5mol。
的物质的量为0.5mol。
答: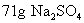 中含有
中含有 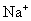 的物质的量为1mol,
的物质的量为1mol, 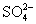 的物质的量为0.5mol。
的物质的量为0.5mol。
[讲述]通过以上例题,明确了解这类型题的步骤和方法。在今后的计算中应该注意解题规范,养成良好的学习习惯。
[投影]练习1.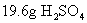 中,氧元素的质量是多少克?
中,氧元素的质量是多少克?
[分析]氧元素是所有氧原子的总称。由已知条件可先求出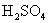 的物质的量,再根据如下关系:
的物质的量,再根据如下关系: 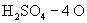 求出氧原子的物质的量,进而求出氧元素的质量。
求出氧原子的物质的量,进而求出氧元素的质量。
参考答案: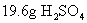 中,氧元素的质量是12.8g。
中,氧元素的质量是12.8g。
[投影]练习2.含有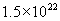 个分子的物质,其质量为0.7g,求该物质的相对分子质量。
个分子的物质,其质量为0.7g,求该物质的相对分子质量。
[分析]根据所给粒子数和阿伏加德罗常数,首先求出物质的量,再根据已有的质量和物质的量求摩尔质量,因为物质的摩尔质量在数值上等于该物质的相对分子质量,所以通过求算出摩尔质量即可知道该物质的相对分子质量。
参考答案:该物质的相对分子质量是28。
[板书]2.不同物质中,某粒子数相当的计算
[投影]例3 多少克硫酸所含的分子数与3.65g 10%盐酸所含的分子数相等。
分析:要满足二者分子数相等,只要满足二者的物质的量相等即可。
解:设质量为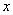 的硫酸所含分子数与3.65g 10%盐酸所含分子数相等。
的硫酸所含分子数与3.65g 10%盐酸所含分子数相等。
(硫酸)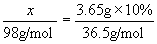 (盐酸)
(盐酸)
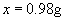
答:0.98克硫酸所含的分子数与3.65g 10%盐酸所含分子数相等。
[讲述]解此类型题的思路是:找准不同物质间的物质的量关系,然后列方程求解。
[投影]课堂检测题
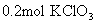 中所含的
中所含的 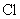 原子数与多少克
原子数与多少克 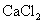 中所含的
中所含的 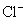 离子个数相等?
离子个数相等?
(参考答案: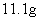 )
)
板书设计
二、摩尔质量
1.1mol物质的质量
1mol任何粒子或物质的质量是以克为单位,在数值上都与该粒子相对原子质量或相对分子质量相等。
2.摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号M。
(2)单位:g/mol或kg/mol
(3)数值:等于物质或粒子的式量
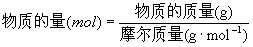
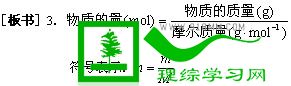
符号表示: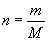
三、关于物质的量的计算
(-)依据
1.准确掌握物质的量、摩尔、摩尔质量等概念。
2.掌握好有关物质质量(m)、物质的量(n)和粒子数(N)之间的关系。
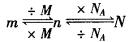
(二)类型
1.物质的质量,物质的量和粒子数之间的相互换算。
2.不同物质中,某粒子数相当的计算。
课题 第一节 物质的量
第二课时
知识目标:
1.使学生了解摩尔质量的概念。了解摩尔质量与相对原子质量、相对分子质量之间的关系。
2.使学生了解物质的量、摩尔质量、物质的质量之间的关系。掌握有关概念的计算。
3. 进一步加深理解巩固物质的量和摩尔的概念。
能力目标:
培养学生的逻辑推理、抽象概括的能力。
培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
情感目标:
使学生认识到微观和宏观的相互转化是研究化学的科学方法之一。培养学生尊重科学的思想。
强调解题规范化,单位使用准确,养成良好的学习习惯。
教学重点:摩尔质量的概念和相关计算
教学难点:摩尔质量与相对原子质量、相对分子质量之间的关系
教学方法:探究式
教学过程
[复习提问]什么是物质的量?什么是摩尔?它们的使用范围是什么?
[回答]物质的量是表示物质所含粒子多少的物理量,摩尔是物质的量的单位。每摩尔物质都含有阿伏加德罗常数个粒子,阿伏加德罗常数的近似值为
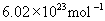 。物质的量和摩尔都只适用于微观粒子,不能用于宏观物体。在使用物质的量时应该用化学式指明粒子的种类。
。物质的量和摩尔都只适用于微观粒子,不能用于宏观物体。在使用物质的量时应该用化学式指明粒子的种类。[引言]既然物质的量是联系微观粒子和宏观物质的桥梁,那么如何通过物质的量求出物质的质量呢?也就是说1mol物质的质量到底有多大呢?我们先填写下面的表格,看是否可以从这些数据中得出有用的结论。
粒子符号物质的
式量每个粒子的质量
(g/个)1摩尔物质含有的
粒子数(个)1摩尔物质质量
(g)
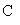
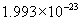
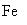
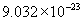
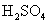
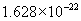
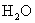
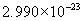
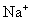
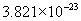
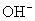
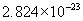
[答案]C的相对原子质量为12,1mol碳原子含有
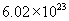 个碳原子,1mol碳原子的质量为
个碳原子,1mol碳原子的质量为 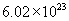 个
个 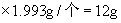 。同理Fe的相对原子质量是56,1mol铁原子含
。同理Fe的相对原子质量是56,1mol铁原子含 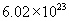 个铁原子,是56g。
个铁原子,是56g。 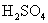 的相对分子质量是98,1mol硫酸含
的相对分子质量是98,1mol硫酸含 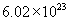 个硫酸分子,是98g。
个硫酸分子,是98g。 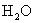 的相对分子质量是18,1mol水含
的相对分子质量是18,1mol水含 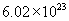 个水分子,质量是18g。电子质量过于微小,因此失去或得到电子的质量可忽略不计,所以
个水分子,质量是18g。电子质量过于微小,因此失去或得到电子的质量可忽略不计,所以 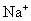 的式量是23。1mol钠离子含有
的式量是23。1mol钠离子含有 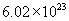 个钠离子,是23g。
个钠离子,是23g。 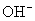 的式量为17。1mol氢氧根离子含
的式量为17。1mol氢氧根离子含 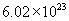 个氢氧根离子,是17g。
个氢氧根离子,是17g。[学生思考]由以上计算结果可得出什么规律?
[结论]①1mol任何原子的质量在数值上等于这种原子的相对原子质量。
②1mol任何分子的质量在数值上等于这种分子的相对分子质量。
③1mol任何离子的质量在数值上等于这种离子的式量。
(此处还可以用其他方法引入得出结论。例如:通过推导得出

[讲解]因为任何一种原子的相对原子质量,是以12C的1/12为标准所得的比值。所以,1 mol任何原子的质量比,就等于它们的相对原子质量比。由此我们可求出x值和y值。
计算得出x=16g y=32g
[得出结论]1 mol任何原子的质量,若以克为单位,在数值上等于其相对原子质量。那么由原子构成的分子,1mol分子的质量应该在数值上等于其相对分子质量。而对于离子,由于电子的质量很小,可以忽略不计。因此1mol任何离子的质量在数值上等于这种离子的式量。)
[板书]二、摩尔质量
1.1mol物质质量
1mol任何粒子或物质的质量是以克为单位,在数值上都与该粒子相对原子质量或相对分子质量相等。
[讨论]为什么1mol任何物质质量在数值上等于该物质的式量?
[分析]相对原子质量是以
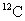 质量的1/12为标准,其他原子的质量跟它相比较所得的比值。如氧的相对原子质量是16。一个碳原子的质量跟一个氧原子的质量之比是12:16,因1mol碳原子与1mol氧原子含有的原子数相等,都约为
质量的1/12为标准,其他原子的质量跟它相比较所得的比值。如氧的相对原子质量是16。一个碳原子的质量跟一个氧原子的质量之比是12:16,因1mol碳原子与1mol氧原子含有的原子数相等,都约为 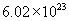 ,所以1摩尔碳原子质量跟1摩尔氧原子质量之比也应该是12:16。1mol碳原子质量是12g,那么1mol氧原子质量就是16g,同理1mol任何原子的质量就是以克为单位,数值上等于该种原子的相对原子质量。对于由分子构成的物质,由于分子是由原子构成的,相对分子质量是各种元素的相对原子质量之和,因此1mol任何分子的质量就是以克为单位,数值上等于该分子的相对分子质量。离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计,所以1mol任何离子的质量在数值上等于该离子的式量。根据以上分析得出1mol任何物质的质量,以克为单位,数值上等于该物质的式量。
,所以1摩尔碳原子质量跟1摩尔氧原子质量之比也应该是12:16。1mol碳原子质量是12g,那么1mol氧原子质量就是16g,同理1mol任何原子的质量就是以克为单位,数值上等于该种原子的相对原子质量。对于由分子构成的物质,由于分子是由原子构成的,相对分子质量是各种元素的相对原子质量之和,因此1mol任何分子的质量就是以克为单位,数值上等于该分子的相对分子质量。离子是通过原子失去或得到电子形成的,电子质量微小,可忽略不计,所以1mol任何离子的质量在数值上等于该离子的式量。根据以上分析得出1mol任何物质的质量,以克为单位,数值上等于该物质的式量。[投影]课堂练习
1.填写下列空白
(1)
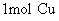 原子质量是 克
原子质量是 克(2)
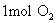 分子质量是 克
分子质量是 克(3)
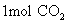 分子质量是 克
分子质量是 克(4)
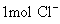 离子质量是 克
离子质量是 克(5)
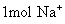 离子质量是 克
离子质量是 克(6)
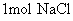 质量是 克
质量是 克[回答]
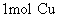 原子是64g;
原子是64g; 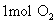 分子是32g;
分子是32g; 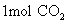 分子是44g;
分子是44g; 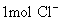 离子为35.5g;
离子为35.5g; 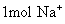 离子是23g;
离子是23g; 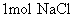 质量为58.5g。
质量为58.5g。[设问]能否说一说什么是摩尔质量?它的单位是什么?数值怎样确定?
[讲述]我们将单位物质的量的物质所具有的质量叫做摩尔质量。也就是说物质的摩尔质量是该物质的质量与该物质的量之比。摩尔质量的符号是M,常用的单位为g/mol或kg/mol。
[板书]2.摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。符号M。
(2)单位:g/mol或kg/mol。
(3)数值:等于物质或粒子的式量。
[投影]课堂练习
2.回答下列问题
(1)
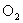 的摩尔质量是多少?
的摩尔质量是多少?(2)
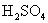 的摩尔质量是多少?
的摩尔质量是多少?回答:(1)
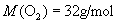 ;
;(2)
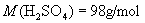
[投影]课堂练习
3.下列物质各多少克?含粒子数多少个?
(1)
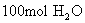 (2)
(2) 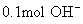
回答:(1)
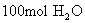 质量是1800g,含有
质量是1800g,含有 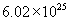 个
个 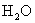 分子。
分子。(2)
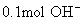 质量是1.7g,含
质量是1.7g,含 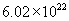 个
个 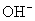
4.下列物质的物质的量是多少?含有多少个粒子?
(1)90g水 (2)56g氮气
[回答](1)90g水物质的量为5mol,含
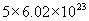 个
个 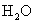 分子
分子(2)56g氮气物质的量为2mol,含
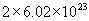 个
个 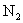 分子
分子[设问]通过以上练习,能不能总结出物质的质量、物质的量、摩尔质量三者间的关系?
[回答]物质的摩尔质量是该物质的质量与该物质的量之比。

[讲述]根据物质的质量和摩尔质量可求出物质的量,反之根据物质的量和摩尔质量也可求出物质的质量。
[板书]三、关于物质的量的计算
(-)依据
[板书]1.准确掌握物质的量、摩尔、摩尔质量等概念。
2.掌握好有关物质的质量(m)、物质的量(n)和粒子数(N)之间的关系。
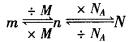
(二)类型
1.物质的质量、物质的量和粒子数之间的相互换算。
[投影]例1
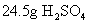 的物质的量是多少?
的物质的量是多少?[分析]我们可以通过
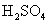 的相对分子质量,得知
的相对分子质量,得知 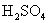 的摩尔质量。然后利用关系式
的摩尔质量。然后利用关系式 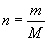 计算出
计算出 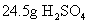 的物质的量。
的物质的量。解:
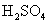 的相对分子质量为98,摩尔质量为
的相对分子质量为98,摩尔质量为 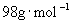 。
。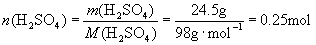
答:
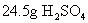 的物质的量为0.25mol
的物质的量为0.25mol[投影]例2
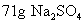 中含有
中含有 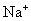 和
和 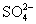 的物质的量各是多少?
的物质的量各是多少?[分析]
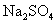 的电离方程式为:
的电离方程式为: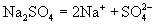
从
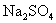 的电离方程式中我们可以看出,
的电离方程式中我们可以看出, 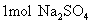 可以电离出
可以电离出 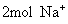 和
和 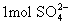 。
。我们可以利用
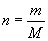 的关系,首先计算出
的关系,首先计算出 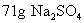 的物质的量,然后再计算出
的物质的量,然后再计算出 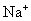 和
和 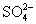 的物质的量。
的物质的量。解:
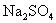 的相对分子质量为142,摩尔质量为
的相对分子质量为142,摩尔质量为 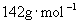 。
。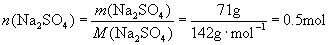
则
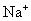 的物质的量为1mol,
的物质的量为1mol, 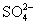 的物质的量为0.5mol。
的物质的量为0.5mol。答:
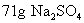 中含有
中含有 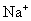 的物质的量为1mol,
的物质的量为1mol, 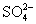 的物质的量为0.5mol。
的物质的量为0.5mol。[讲述]通过以上例题,明确了解这类型题的步骤和方法。在今后的计算中应该注意解题规范,养成良好的学习习惯。
[投影]练习1.
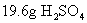 中,氧元素的质量是多少克?
中,氧元素的质量是多少克?[分析]氧元素是所有氧原子的总称。由已知条件可先求出
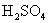 的物质的量,再根据如下关系:
的物质的量,再根据如下关系: 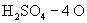 求出氧原子的物质的量,进而求出氧元素的质量。
求出氧原子的物质的量,进而求出氧元素的质量。参考答案:
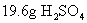 中,氧元素的质量是12.8g。
中,氧元素的质量是12.8g。[投影]练习2.含有
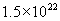 个分子的物质,其质量为0.7g,求该物质的相对分子质量。
个分子的物质,其质量为0.7g,求该物质的相对分子质量。[分析]根据所给粒子数和阿伏加德罗常数,首先求出物质的量,再根据已有的质量和物质的量求摩尔质量,因为物质的摩尔质量在数值上等于该物质的相对分子质量,所以通过求算出摩尔质量即可知道该物质的相对分子质量。
参考答案:该物质的相对分子质量是28。
[板书]2.不同物质中,某粒子数相当的计算
[投影]例3 多少克硫酸所含的分子数与3.65g 10%盐酸所含的分子数相等。
分析:要满足二者分子数相等,只要满足二者的物质的量相等即可。
解:设质量为
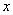 的硫酸所含分子数与3.65g 10%盐酸所含分子数相等。
的硫酸所含分子数与3.65g 10%盐酸所含分子数相等。(硫酸)
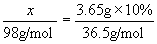 (盐酸)
(盐酸)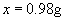
答:0.98克硫酸所含的分子数与3.65g 10%盐酸所含分子数相等。
[讲述]解此类型题的思路是:找准不同物质间的物质的量关系,然后列方程求解。
[投影]课堂检测题
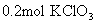 中所含的
中所含的 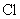 原子数与多少克
原子数与多少克 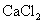 中所含的
中所含的 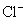 离子个数相等?
离子个数相等?(参考答案:
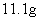 )
)板书设计
二、摩尔质量
1.1mol物质的质量
1mol任何粒子或物质的质量是以克为单位,在数值上都与该粒子相对原子质量或相对分子质量相等。
2.摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号M。
(2)单位:g/mol或kg/mol
(3)数值:等于物质或粒子的式量
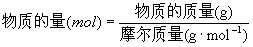
符号表示:
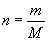
三、关于物质的量的计算
(-)依据
1.准确掌握物质的量、摩尔、摩尔质量等概念。
2.掌握好有关物质质量(m)、物质的量(n)和粒子数(N)之间的关系。
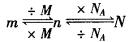
(二)类型
1.物质的质量,物质的量和粒子数之间的相互换算。
2.不同物质中,某粒子数相当的计算。
